スタッフ
| 教授 | 福島 聡 s_fukushima(アットマーク)kumamoto-u.ac.jp |
|---|---|
| 准教授 | 牧野 雄成 |
| 助教 | 柏田 香代 |
| 助教 | 木村 俊寛 |
| 助教 | 澤村 創一郎 |
研究テーマ
【研究プロジェクト名および概要】
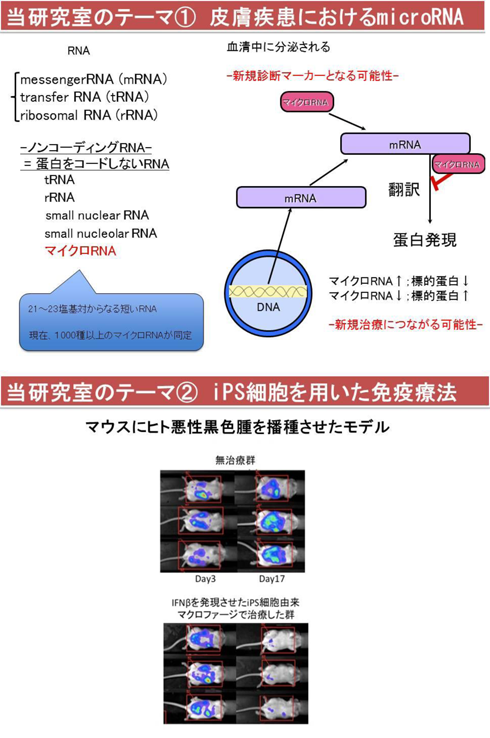
1.皮膚疾患におけるmicro RNA
エピジェネティクスは生体内の様々な細胞の機能に影響するため、注目されている講座です。生体内においては生理的に、細胞核内のDNAからmRNAが転写、翻訳され、蛋白合成を行っています。その過程で、21-23塩基からなる短いRNAが存在し、microRNA (miRNA)と呼ばれています。miRNAからアミノ酸へ翻訳されることはありませんが、特異的なmRNAからアミノ酸への翻訳を抑制的に制御していることがわかってきました。さらに、当科では様々なmiRNAが皮膚における発現量が変化することで、病態に深く関与していることや血清や毛髪に発現しており、診断マーカーとなる可能性を報告してきました。今後は難治性皮膚疾患に対する新規治療へ向けて、さらなる研究を続けています。
2.iPS細胞を用いた免疫療法
iSP細胞は多能性と無限増殖能を有するため再生医療のソースとして注目されていますが、当教室ではiPS細胞を細胞治療のソースと考えたがん免疫療法の研究を行っています。ヒトのiPS細胞からマクロファージへ誘導し、インターフェロンαやβ等の細胞障害活性あるいは免疫調整能をもった分子を発現させた細胞ラインを樹立します。マウスの体内にヒトの悪性黒色腫の細胞を移植したものにこのiPSマクロファージを移入し、非常に高い抗腫瘍効果を確認しています。今後、悪性黒色腫の克服をめざし、臨床応用に向けた研究を続けていきます。
1.micro RNA in collagen diseases and skin diseases
Recently, epigenetics has attracted attention for its involvement in the various cellular behaviors and cell functions. microRNAs (miRNAs), short RNA molecules on average only 22 nucleotides long, play as the post-transcriptional regulators that bind to complementary sequences of target mRNAs, leading to the inhibition of translation. As previously reported, miRNAs have been implicated in the pathogenesis of various human diseases, such as immunological disorders, cancers, and metabolic disorders. However, little is known about the role of miRNAs in skin diseases. In previous study, we investigated the possibility that miRNAs may be involved in the pathogenesis of skin diseases. Clarifying the regulatory mechanisms of miRNAs may lead to develop new serum marker and therapeutic drugs by transfection into involved skin in vivo.
2.We have conducted a study of immune cell therapy using iPS cells. The benefit of our method is that a large number of cells can be readily obtained, and it is able to express additional function on immune cells by genetic modification. We made an attempt to evaluate the potential of iPS cells as anti-cancer effector cells using genetically modification to express type I IFNs. We reported that iPS cell-derived immune cells expressing type I IFNs could exert therapeutic effects against peritoneally disseminated malignant melanoma in xenograft models. Though a further preclinical study for the establishment of the safety is necessary, this method will bring rays of hope for the patients with malignant melanoma.