倫理審査に先立つ研修の受講について
研究者等および研究責任者は、研究の実施に先立ち、Aprin(旧:CITI Japan)eラーニング講座にある医学研究者標準コースを受講、修了する必要があります。
未受講者は、登録票を研究支援担当(ski-shien@jimu.kumamoto-u.ac.jp)に提出し、IDを付与されたあと、受講してください。
研究倫理委員会
基本情報
人を対象とする生命科学・医学系研究疫学・一般部門倫理委員会
人を対象とする生命科学・医学系研究臨床研究部門倫理委員会
人を対象とする生命科学・医学系研究ヒトゲノム・遺伝子解析研究部門倫理委員会
ヒトES細胞研究倫理委員会
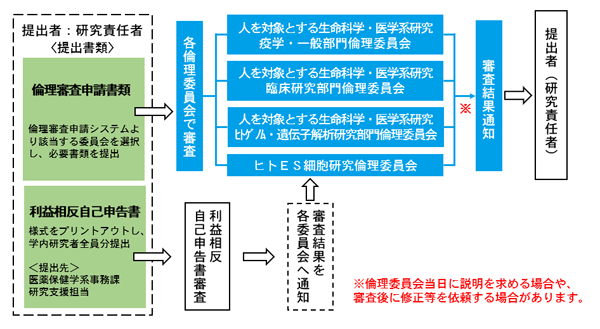
審査のながれ
基本的には上記図のとおり
審査対象部局
大学院生命科学研究部、大学院医学教育部、大学院保健学教育部、大学院薬学教育部、医学部、薬学部、 病院、発生医学研究所、国際先端医学研究機構、生命資源研究・支援センター 、ヒトレトロウイルス学共同研究センター
機関の長
大学院生命科学研究部長・・・病院長が責任者となるものを除く
病院長・・・・・・・・・・・・・・・・・・・科学的合理性に鑑みて、臨床研究、医療技術、検査及び特殊製剤に関することのほか、大学院生命科学研究部等研究倫理委員会連絡会議で臨床研究に関する倫理委員会で審査することとされたもの
※なお、ヒトES細胞の使用に当たっては、使用機関の長(使用責任者が所属する部局の長)の監督、指導のもとで研究を行う。
基本に関する規則
書類の提出先およびお問い合わせ先
医薬保健学系事務課 研究支援担当
(場所:基礎医学研究棟1階 内線:5657 メール:ski-shien@jimu.kumamoto-u.ac.jp)
1.人を対象とする生命科学・医学系研究疫学・一般部門倫理委員会
「人を対象とする生命科学・医学系研究に関する倫理指針」に対応の研究、適応指針の分類が難しい研究を審査
開催日
不定期
提出書類
【新規の場合】(◆は必須、それ以外は必要に応じて)
◆申請書、◆研究計画書もしくは多施設共同研究概要書、◆説明同意文書及び同意撤回書、公開文書、◆利益相反自己申告書(熊本大学所属の研究者全員分)、既存試料・情報の提供に関する届出書、および実際に使用するアンケートや調査票、多施設共同研究の場合は代表施設の計画書とIRB承認書の写し
【計画変更の場合】(◆は必須、それ以外は必要に応じて)
◆計画(変更・中止)申請書、◆新旧対照表、◆改訂した書類(研究計画書、同意説明文書および同意書)、
利益相反自己申告書(研究者の変更または利益相反に関する変更がある場合のみ)
【参考】計画書、同意説明文の利益相反に関する記載例
提出時期
随時ご提出ください(目安は研究開始予定時期の1~2ヶ月程度前)
提出方法
ページトップの倫理委員会電子システムにて申請。様式は申請ページを参照ください。
問合せ先
医薬保健学系事務課 研究支援担当
(基礎医学研究棟1階 内線:5657)
その他の様式について
中止・終了報告書、実施状況報告書、その他事象に関する報告書等の様式は、倫理委員会電子システムの申請メニューにそれぞれ掲載しています。
2.人を対象とする生命科学・医学系研究臨床研究部門倫理委員会
「人を対象とする生命科学・医学系研究に関する倫理指針」に対応の臨床研究、医療技術、臨床検査、特殊製剤に関する研究を審査
開催日
通常審査(会議)は定例開催。原則毎月第3月曜日、8月は休会
提出書類
【新規の場合】(◆は必須、それ以外は必要に応じて)
◆申請書、◆研究計画書、◆利益相反自己申告書(熊大所属の研究者全員分)、◆説明同意文書及び同意撤回書、他の研究機関への既存試料・情報の提供に関する届出書、◆申請書チェックシート、公開文書、多施設共同研究概要書、実際に使用するアンケートや調査票多施設共同研究の場合(多施設IRB承認書(写)及び多施設共同研究の研究計画書)
【計画変更の場合】(◆は必須、それ以外は必要に応じて)
◆計画(変更・中止)申請書、◆新旧対照表、◆改訂した書類(研究計画書、同意書等)
利益相反自己申告書(研究者の変更または利益相反に関する変更がある場合のみ)
【参考】計画書、同意説明文の利益相反に関する記載例
提出時期
原則、審査日の1ヶ月前(迅速審査は随時行う)
提出方法
ページトップの倫理委員会電子システムにて申請。様式は申請ページを参照ください。
問合せ先
病院事務部 経営戦略課 先進医療担当
(管理棟3階 内線:5966)
その他の様式について
(中止・終了)報告書(提出時期:変更命令を受けて研究を中止・終了した時点)、有害事象報告書(医薬品)・有害事象報告書(医療機器)(提出時期:該当する有害事象が生じた時点)、実施状況報告書(提出時期:1年に1回。提出時期については別途通知。)は倫理委員会電子システムの倫理申請の申請メニューにそれぞれ掲載しています。
3.人を対象とする生命科学・医学系研究ヒトゲノム・遺伝子解析研究部門倫理委員会
「人を対象とする生命科学・医学系研究に関する倫理指針」に対応の研究、ヒトゲノム及び遺伝子の構造又は機能並びに遺伝子の変異又は発現に関する研究を審査
開催日
不定期開催
提出書類
【新規の場合】(◆は必須、それ以外は必要に応じて)
◆申請書、◆研究計画書、◆同意説明文書、◆利益相反自己申告書(熊大所属の研究者全員分)、提供・分譲計画書、公開文書、多施設IRB承認書(写)
【計画変更の場合】(◆は必須、それ以外は必要に応じて)
◆計画変更申請書、◆新旧対照表、◆改訂した書類(研究計画書、同意説明文書および同意書)
利益相反自己申告書(研究者の変更または利益相反に関する変更がある場合のみ)
提出時期
随時ご提出ください(目安は研究開始予定時期の1~2ヶ月程度前)
提出方法
ページトップの倫理委員会電子システムにて申請。様式は申請ページを参照ください。
問合せ先
医薬保健学系事務課 研究支援担当
(基礎医学研究棟1階 内線:5657)
その他の様式について
中止・終了報告書、実施状況報告書、その他事象に関する報告書等の様式は、倫理委員会電子システムの申請メニューにそれぞれ掲載しています。
4.ヒトES細胞研究倫理委員会(平成29年4月より休会)
「ヒトES細胞の分配及び使用に関する指針」に対応の研究を審査
開催日
不定期開催
提出書類
【新規の場合】申請書
【計画変更の場合】計画(変更・中止)
提出時期
随時ご提出ください(目安は研究開始予定時期の1~2ヶ月程度前)
問合せ先
医薬保健学系事務課 医学事務チーム研究支援担当
(基礎医学研究棟1階 内線:5657)
その他の様式について
- 使用完了報告書(提出時期:研究が終了した時点)
- 使用経過報告書(提出時期:随時)
参考資料
(文部科学省ホームページ)
生命倫理・安全に対する取組
(厚生労働省ホームページ)
厚生労働科学研究に関する指針
中央一括審査について
新指針より、多機関共同研究を実施する場合、各機関の研究責任者の中から、研究代表者を選出し、選出された研究代表者は原則研究代表者の機関の倫理審査委員会に一括審査を求めることとなりました。
申請から研究許可までの流れは下記図を参照ください。
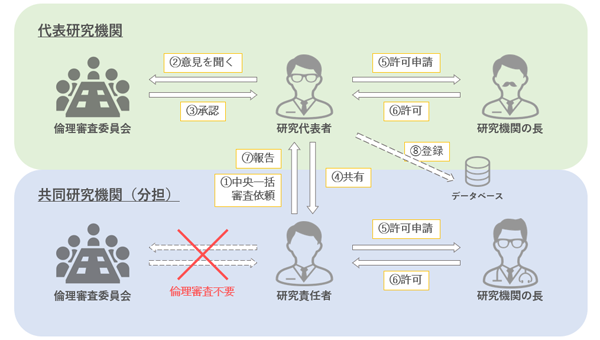
(本学が代表研究機関の場合)
必要書類
倫理審査委託依頼書、研究実施に関する要件確認書
様式は申請ページを参照ください。
申請方法
研究代表者は、倫理審査委員会電子システムにて上記の書類を研究計画書の添付資料として提出し、承認を得てください。
倫理委員会の承認を得ましたら、研究機関長(本学では研究部長、病院長)へ許可申請を行い、許可を得て初めて研究を開始することができます。
また、他機関の研究責任者へは審査結果通知書、研究計画書等の共有を行ってください。
(本学が共同研究機関の研究責任者の場合)
依頼書など審査を行う委員会が求める書類を研究代表者へ提出してください。
また、中央一括審査にて承認を受けた場合は、速やかに研究代表者から共有された審査結果通知書、研究計画書等を添えて、研究部長、病院長へ許可申請し、研究開始の許可を受けてください。許可が得られてから初めて研究に参加することが可能です。
なお、1つの研究のなかで、中央一括審査を求める共同研究機関と、自機関にて個別審査を行う共同研究機関が混在することも認められます。
研究等にかかる利益相反について
各倫理委員会へ申請を行う研究等実施者(治験含む)は、「利益相反自己申告書」の提出が必要です。利益相反審査の流れは下記図を参照ください。
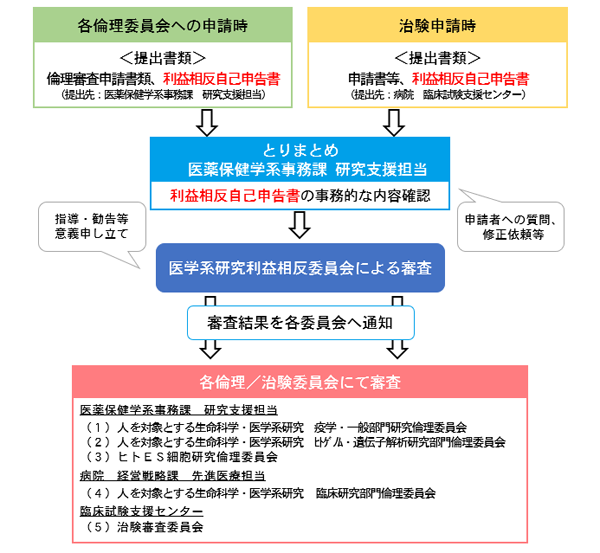
利益相反の手続き
- 研究等にかかる利益相反 提出について 様式 関係規則(必ずお読みください)
- 研究等を継続するとき(4月1日現在) 提出方法 様式
研究等にかかる利益相反
研究等にかかる利益相反は、当該研究者の経済的な利益(金銭など)やその他の関連する利益(地位や利権など)の情報を適切に開示し、研究等の実施やその情報の普及・提供が適正になされているかどうかを客観的に判断し評価していくことが求められており、また研究等の実施が経済的な利益により影響されていないかを監視していくシステムとしても必要とされています。
従いまして、各倫理審査の申請を行う際には「利益相反自己申告書」の提出が必要です。以下の方法で提出をお願いします。
提出について
研究責任者が研究者全員分(熊本大学所属のみ)を取りまとめて提出してください。
●新規申請の場合・・・倫理審査申請の研究計画書に記載されている研究者全員分
●変更申請の場合・・・研究者の追加や利益相反の状態が変更となった場合に該当する研究者分
利益相反自己申告書は個人情報となるので、必ず取りまとめて封筒に入れ、封をし封筒の表に「課題名、研究責任者、担当者連絡先」を書いて提出してください。
提出先
(1)~(4)倫理委員会は医薬保健学系事務課 医学事務チーム 研究支援担当(内線5730)
(5)は病院臨床試験支援センター(毎月締切日あり)へ学内便または持参にて提出ください。
様式
研究を継続するとき(治験を除く)
熊本大学大学院生命科学研究部等における医学系研究に係る利益相反管理規則第8条第2項に基づき毎年4月1日現在における申告書を提出しなければなりません。
提出方法
報告時期(毎年3月頃)に下記書類をお送りします。
- 医学系研究に係る利益相反自己申告書の提出について(依頼)
- 継続中の研究課題一覧
- 医学系研究に係る利益相反状況について(報告)
書類が届きましたら内容を確認いただき、分野責任者の押印のうえ提出ください。
研究内容に変更が生じていることが判明した場合は速やかに必要書類を提出ください。
様式
厚生労働科学研究費等にかかる利益相反
平成26年度から厚生労働科学研究費・労災疾病臨床研究、平成27年度から日本医療研究開発機構において、倫理審査および利益相反の管理の状況に関する報告が必要になりました。(平成27年12月現在)
熊本大学所属の研究代表者および研究分担者は熊本大学大学院生命科学研究部等医学系研究利益相反審査委員会において利益相反審査を必ず受ける必要があります。(研究(臨床・基礎など)・部局に関係なく)
手続のながれ
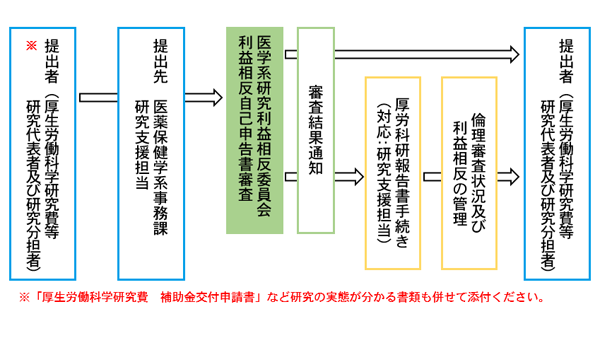
提出方法
- 厚生労働科学研究費等の交付申請書(写)または交付申請書2、3、5、7~11の内容をとりまとめたもの
- 厚生労働科学研究費等の調査研究における倫理審査状況シート
- 利益相反自己申告書 の3点をご提出ください。
提出先 : 医薬保健学系事務課 研究支援担当(内線5657)
様式
利益相反自己申告書
厚生労働科学研究費等の調査研究における倫理審査状況シート
参考
平成26年4月14日通知
「厚生労働科学研究費における倫理審査及び利益相反の管理の状況に関する報告について」
平成20年3月策定、平成27年4月1日一部改正
「厚生労働科学研究費における利益相反(Conflict of Interest : COI)の管理に関する指針」
病院医療行為等適応審査委員会
医療行為の実施の適否その他の事項について、倫理的観点及び科学的観点を審査
開催日
通常審査(会議)は原則として、人を対象とする生命科学・医学系研究臨床研究部門倫理委員会と同日(原則毎月第3月曜日、8月は休会)
提出書類
【新規の場合】(◆は必須、それ以外は必要に応じて)
◆申請書、◆実施計画書、◆同意書、添付文書・ガイドラインなど
【計画変更の場合】(◆は必須、それ以外は必要に応じて)
◆計画(変更・中止)申請書、◆新旧対応表、◆改訂した書類(実施計画書、同意書)
提出方法
ページトップの倫理委員会電子システムにて申請。様式は申請ページを参照ください。
提出先・問合せ先
病院事務部 経営戦略課 先進医療担当 (管理棟3階 内線:5966)
その他の様式
- 実施状況報告書
- 有害事象報告書
症例報告等の倫理審査
提出書類(◆は必須、それ以外は必要に応じて)
◆症例報告審査申請書、◆報告内容が分かるもの(発表スライド、投稿原稿等)、
◆説明、同意等に関する証拠書類、報告に関する学会、学術誌等の規程
提出先・問い合わせ先
原則、審査日の1ヵ月前(迅速審査は随時行う)
提出先・問合せ先
病院事務部 経営戦略課 先進医療担当
(管理棟3階 内線:5966 E-mail:byi-senshin@jimu.kumamoto-u.ac.jp)
このページに関するお問い合わせ
熊本大学医薬保健学系事務課
研究支援担当
- (TEL)
- 096-373-5657
- (FAX)
- 096-373-5797

