スタッフ
| 教授 | 富澤 一仁 tomikt(アットマーク)kumamoto-u.ac.jp |
|---|---|
| 准教授 | 中條 岳志 tchujo(アットマーク)kumamoto-u.ac.jp |
| 助教 | 佐藤 恭介 satok(アットマーク)kumamoto-u.ac.jp |
研究テーマ
【研究プロジェクト名および概要】
Ⅰ.tRNA修飾と疾患発症
細菌や酵母においてtRNAは複雑な化学修飾を受けていることは知られていた。一方、ヒトにおけるtRNA修飾研究は、疾患との関連性が不明だったためこれまでほとんど研究がされてこなかった。我々は、2型糖尿病の危険因子であるCdkal1が、リジンに対応するtRNAの修飾酵素であることを見出した。膵β細胞特異的Cdkal1欠損マウスを作製し、Cdkal1機能欠損がインスリン分泌を抑制する分子機構を明らかにした[J Clin Invest 121, 3598 (2011)]。また、Cdkal1以外に新しいtRNA修飾酵素を多数発見し、これらノックアウトマウスや患者検体などを用いて新規に発見したtRNA修飾酵素の生理機能を解析している。tRNA修飾異常が糖尿病以外に不整脈、精神遅滞、ミトコンドリア病など様々な疾患の発症に関与していることが明らかになってきた。
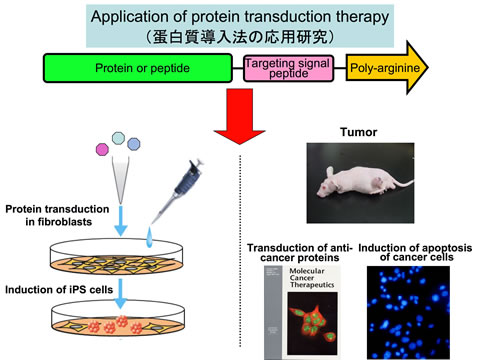
Ⅱ.蛋白質導入法の応用研究、とくにiPS細胞から膵β細胞分化誘導技術や抗がんペプチド開発への応用
ペプチド、蛋白質に9-11個から成るポリアルギニンを付加することにより細胞内に導入・機能させる技術開発を行った(蛋白質導入法)。現在、本技術を用いた応用研究を実施している。具体的には、本技術を用いてヒトiPS細胞に3~4つの遺伝子産物である蛋白質を導入し、膵β細胞への分化を誘導する技術開発を行っている。従来の技術より、効率良くまた安全に分化させることに成功している。さらに、抗癌性ペプチドを蛋白質導入法により癌細胞に特異的に導入し、癌細胞を死滅させる新規癌治療法の開発研究を実施している。
Ⅰ.tRNA modifications and diseases
It has been known that tRNAs are chemically modified in bacteria and yeast. In contrast, the human study had not been done because it was unknown that abnormal tRNA modification caused the development of diseases. We first identified that Cdkal1 was a tRNA modification enzyme, which catalyzed tRNAMLys. We generated pancreatic b cell-specific knockout mice and shoed the molecular mechanism on deficit of Cdkal1 function inhibited insulin secretion using the mice. Moreover, we recently novel tRNA modification enzyme in human and are demonstrating the physiological functions of these enzymes using each knockout mice and patient samples. We clarified that abnormal tRNA modifications are involved in the development of some diseases such as arrhythmia, mental retardation and mitochondrial diseases in addition to diabetes.
Ⅱ.Development of protein transduction therapy and the application for the induction of differentiation of human iPS cells to pancreatic b cells and anti-cancer therapy
We developed a protein transduction therapy using poly-arginine. We are capable of delivering and functioning proteins and peptide in cells using the method. We are now trying the induction of differentiation of human iPS cells to pancreatic b cells by protein transduction therapy. We succeeded to develop the method and to generate the cells efficiently and safety. Moreover, we are developing membrane-permeable anti-cancer peptides targeting to tumor in vivo using protein transduction therapy.