- ホーム
- 講座
- 先端生命医療科学部門
- 微生物学
スタッフ
| 教授 | 澤 智裕 sawat(アットマーク)kumamoto-u.ac.jp |
|---|---|
| 講師 | 津々木 博康 tsutsuki(アットマーク)kumamoto-u.ac.jp |
| 助教 | 小野 勝彦 onokat(アットマーク)kumamoto-u.ac.jp |
| 助教 | 門出 和精 monde(アットマーク)kumamoto-u.ac.jp |
研究テーマ
【研究プロジェクト名および概要】
細菌は多彩な酸素要求性を持つことが知られているが、それを規定する要因として、活性酸素に対する抵抗性が重要であると考えられている。活性酸素は好気呼吸に加え、宿主細胞による自然免疫応答、さらに抗菌剤処理によっても生成するため、細菌はこれら活性酸素暴露に対して抗酸化メカニズムを使い、生き延びようとしている。システインパースルフィド(図1)はその存在が、動物細胞中にごく最近みつかった分子であり、その極めて高い抗酸化能から、生体の抗酸化メカニズムを担う分子として注目されている。我々は、いまだほとんど分かっていない細菌のパースルフィドについて、分子多様性と生成経路を明らかにし、さらにパースルフィドが細菌の活性酸素抵抗性にどのような役割を担っているのかを明らかにすることを目的として研究を行っている。これらの基盤研究に基づき、細菌に固有のパースルフィド経路を標的とした新しい感染症の治療法、予防法、診断法への展開を目指している。また本研究を通じて、活性酸素に対する普遍的な抵抗メカニズムを明らかにし、癌、メタボリック・シンドローム、神経変性疾患をはじめとする酸化ストレス関連疾患の病態形成メカニズムの理解にも取組む。
私たちの研究室はレトロウイルス特にヒト免疫不全ウイルス(HIV)とヒトT細胞白血病ウイルス (HTLV)の感染機構とヒト内在性レトロウイルスの制御機構の研究している。とくにウイルスの細胞受容体への吸着から粒子形成、放出までをウイルス学的あるいは分子生物学的手法を用いて解析し、ウイルスと宿主との関連を明らかにすることを目的としている。 これらの研究の成果を、レトロウイルスによる病態解明および新しい制御方法の開発に役立てたいと考えている。
当分野では上記テーマに加え、新興感染症菌ヘリコバクター・シネディ感染病態の分子メカニズムについて、特に慢性炎症性疾患との関連から研究を行っている。
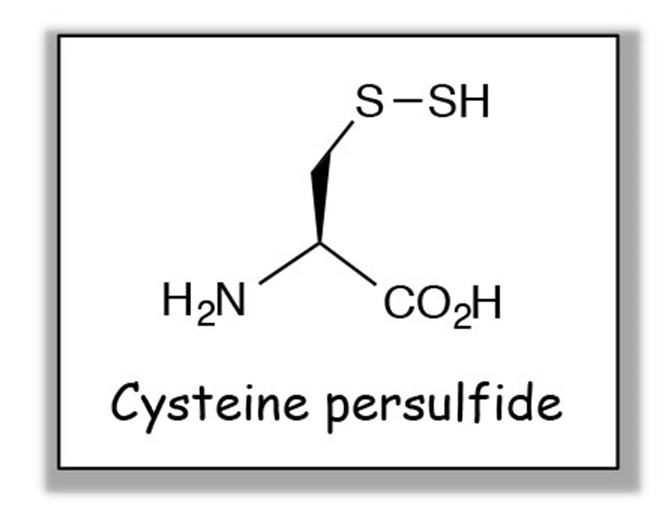
図1.システインパースルフィドの構造.
Fig. 1. Structure of cysteine persulfide.
Bacteria exhibit diverse oxygen demands that are determined by, at least in part, their capability of resistance to reactive oxygen species (ROS). In order to survive under production of ROS derived from aerobic respiration, innate immune responses, and antibiotic treatment, bacteria equip antioxidant mechanisms. Recently, cysteine persulfides (Fig. 1) have been identified in mammalian cells as powerful antioxidant molecules. We aim to clarify molecular species and the biosynthetic mechanisms of bacterial persulfides, with particular emphasis on the elucidation of antioxidative functions of bacterial persulfides. Understanding molecular basis of bacterial antioxidative resistance may help us to develop treatment, prevention and diagnosis for bacterial infection, as well as to gain insights into a variety of oxidative stress-associated human diseases including cancer, metabolic syndrome, and neurodegenerative diseases.
Our laboratory also focuses on understanding of replication cycle of human pathogenic retroviruses including Human Immunodeficiency Virus (HIV) and Human T-cell Leukemia Virus 1 (HTLV-1), and regulatory mechanisms of human endogenous retrovirus (HERV). Of particular interest is the virus-host interaction in retroviral infection. Information obtained from virological and molecular biological approaches has been applied to elucidation of the pathogenesis of retroviral infection and developing novel therapeutic strategies against retroviral infection.
We also study molecular pathogenesis of emerging bacterium Helicobacter cinaedi infection and its association with chronic inflammatory diseases.

